考前冲刺(八)
| 一、单选题 |
| 1.用高锰酸钾的硫酸溶液与下列物质加热反应,得不到二氧化碳者是( )。 |
正确答案:C 解题思路:高锰酸钾的硫酸溶液可以容易地将甲酸氧化成二氧化碳。因在乙烯、丙烯和1-丁烯分子中都存在双键CH.gif) ,在对它们进行氧化时,都可以先得到甲酸,然后再被氧化成二氧化碳,而对2-丁烯进行氧化时,得到的是两分子乙酸,故选项C正确。 ,在对它们进行氧化时,都可以先得到甲酸,然后再被氧化成二氧化碳,而对2-丁烯进行氧化时,得到的是两分子乙酸,故选项C正确。 |
|
|
| 2.已知下列反应的平衡常数: Fe(s)+CO .gif) (g)=FeO(s)+CO(g),为 (g)=FeO(s)+CO(g),为.gif) Fe(s)+H .gif) O(g)=FeO(s)+H O(g)=FeO(s)+H.gif) (g),为 (g),为.gif) 则反应CO .gif) (g)+H (g)+H.gif) (g)=CO(g)+H (g)=CO(g)+H.gif) O(g)的平衡常数K O(g)的平衡常数K 为( )。 为( )。 |
| 正确答案:C 解题思路:题目所给的第三个反应是由第一个反应减去第二个反应得到的,根据"多重平衡法则",第三个反应的平衡常数应该等于第一个反应的平衡常数除以第二个反应平衡常数,正确答案是C。 |
|
|
3.在300K的恒定温度下,将3.0升压力为3.0×10.gif) Pa的氧气与氢气的混合气体封闭在一个刚性容器中,点火反应完全后剩余氢气的压力(忽略水的蒸汽压)为1.0×10 Pa的氧气与氢气的混合气体封闭在一个刚性容器中,点火反应完全后剩余氢气的压力(忽略水的蒸汽压)为1.0×10.gif) pa,则反应前氧气的分压是( )。 pa,则反应前氧气的分压是( )。 |
正确答案:B 解题思路:由于氢气和氧气的反应可以进行得很完全,所以通过反应已经把混合气体中的氧气消耗完,根据所发生的反应可知:每反应掉1分子氧气,就会消耗掉2分子氢气。反应后生成的水在300K时是液体,其体积可以被忽略,同时忽略掉水的蒸气压,则剩余氢气的物质的量为.gif) =(1.0×10 =(1.0×10.gif) ×3.0×10 ×3.0×10 /8.314×300)mol,设反应前混合气体中氧气的物质的量为 /8.314×300)mol,设反应前混合气体中氧气的物质的量为.gif) ,则反应前混合气体总的物质的量为3 ,则反应前混合气体总的物质的量为3.gif) + +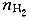 =(3.0×10 =(3.0×10.gif) ×3.0×10 ×3.0×10.gif) /8.314×300)mol,故 /8.314×300)mol,故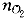 =(2.0×10 =(2.0×10.gif) ×3.0×10 ×3.0×10 /3×8.314×300)mol,根据分压的定义可以计算得出反应前氧气的分压是2/3×10 /3×8.314×300)mol,根据分压的定义可以计算得出反应前氧气的分压是2/3×10 Pa。B是正确答案。 Pa。B是正确答案。 |
|
|
| 4.下列说法正确的是: |
| 正确答案:A 解题思路:取向力是指固有偶极之间的作用力,而只有极性分子才有固有偶极,所以选项A是正确的;极性分子会诱导其他任何分子产生诱导偶极,因此,极性分子之间也会存在诱导力,而所有分子都会产生瞬时偶极,所以极性分子之间也存在着色散力,很明显,选项B错误;分子之间的作用力主要与分子量的大小、分子的极性、以及分子之间能否形成氢键等因素有关,最重要的因素是分子量的大小,所以选项C错误;氢键只能形成在具有F、O、N与氢形成的强极性共价键的分子与含电负性很大的F、O、N原子(带有孤电子对)的分子之间,故选项D也是错误的。 |
|
|
| 5.将丙烯通入适量的溴水中可以使溴水退色,其原因是( )。 |
| 正确答案:A 解题思路:丙烯分子中具有双键,通入适量的溴水中因发生加成反应得到无色的1,2-二溴丙烷,而使溴水的红棕色退去。 |

