粗面内质网的功能――蛋白质转运[细胞生物学]
发布时间:2011-10-18 共1页
粗面内质网的功能――蛋白质转运
粗面内质网的主要功能是帮助膜结合核糖体合成的蛋白质转运。膜结合核糖体上合成的蛋白质与游离核糖体上合成的蛋白质去向是不同的,表9-5列出了这两类核糖体合成的某些蛋白。
表9-5 真核细胞中膜结合核糖体和游离核糖体合成的某些蛋白
| 膜结合核糖体 | 游离核糖体 |
| 分泌蛋白 | 可溶性胞质溶胶蛋白 |
| 肽类激素 | 脂锚定膜蛋白 |
| 生长因子 | (位于质膜的胞质面) |
| 消化酶类 | 外周蛋白 |
| 血清蛋白 | (质膜的胞质面) |
| 细胞外基质蛋白 | 核基因编码的线粒体蛋白 |
| 释放到ER腔中的蛋白 | 核基因编码的叶绿体蛋白 |
| RER中的酶类 | 过氧化物酶体蛋白 |
| 高尔基复合体的酶 | 核蛋白 |
| 溶酶体的酶 | |
| 整合膜蛋白 | |
| ER膜的糖蛋白 | |
| 高尔基体的膜糖蛋白 | |
| 溶酶体膜糖蛋白 | |
| 质膜糖蛋白 | |
| 核膜糖蛋白 | |
| 脂锚定质膜蛋白 | |
| 质膜的外周蛋白(位于质膜的外侧面) |
由于粗面内质网上合成的蛋白质包括膜蛋白、内膜结构的腔池蛋白和分泌到细胞外的蛋白, 所以必须有极好的运输机制进行分选定位, 这就是信号肽假说。
■ 信号序列的发现和证实
● 微粒体实验
在George Palade用离心技术分离到有核糖体结合的微粒体,即发现膜结合核糖体(membrane-bounded ribosome)之后, 科学家推测:膜结合核糖体合成的蛋白质首先要进入内质网的腔,然后通过选择性的分泌过程输出到细胞外,而游离核糖体上合成的蛋白质则留在细胞内使用。
为了研究内质网上合成的蛋白质是否进入了内质网的腔, Colvin Redman 和 David Sabatini用分离的RER小泡(微粒体)进行无细胞系统的蛋白质合成, 证明了膜结合核糖体上合成的蛋白质进入了微粒体的腔。
如何利用微粒体在无细胞蛋白质合成系统中的合成实验证明膜结合核糖体合成的蛋白质进入了微粒体的腔
● Günter Blobel等的建议
为什么有些核糖体合成蛋白质时不同内质网结合,有些正在合成蛋白质的核糖体要同内质网结合,并将合成的蛋白质插入内质网?对此,美国洛克菲勒大学的 Günter Blobel、David Sabatini 和Bernhard Dobberstein 等于1971年提出两点建议:
①分泌蛋白的N-端含有一段特别的信号序列(signal sequence),可将多肽和核糖体引导到ER膜上;②多肽通过ER膜上的水性通道进入ER的腔中,并推测多肽是在合成的同时转移的。
● 信号序列存在的直接证据
1972年,César Milstein和他的同事用无细胞系统研究免疫球蛋白(IgG)轻链合成时获得了信号序列存在的直接证据, 证明Blobel等的建议是正确的。他们用分离纯化的核糖体在无细胞体系中用编码免疫球蛋白轻链的mRNA指导合成多肽,发现合成的多肽比分泌到细胞外的成熟的免疫球蛋白在N端有一段多出的肽链, 它有20个氨基酸,他们推测,这段肽具有信号作用,使IgG得以通过粗面内质网并继而分泌到细胞外。
● 信号序列的进一步证实
G.Blobel、B.Dobberstein、P.Walter和他们的同事在上述发现的基础上用分离的微粒体和无细胞体系进行了大量的实验,进一步证实了信号序列的存在及其作用。
加与不加RER小泡,产物不同 当将分泌蛋白的mRNA在无细胞体系中进行翻译时, 如果不加粗面内质网(微粒体), 获得的翻译产物比从细胞中分泌出来的蛋白要长,若添加RER小泡,翻译的产物长度与从活细胞分泌的蛋白相同。因此推测信号序列在引导蛋白进入内质网后被切除了,所以成熟的蛋白的N-端没有信号序列(图9-16)。

图9-16 信号序列在分泌蛋白质运输中的作用
(a) 在不含RER小泡的无细胞体系中翻译分泌蛋白,其N-端有信号序列,故比从细胞中分泌出来的相同蛋白质肽链长;(b)在加有RER小泡的无细胞体系中翻译分泌蛋白,信号序列在RER小泡中被切除,得到的产物与从细胞中合成分泌的相同。
蛋白水解酶水解实验 在分泌蛋白进行体外翻译的无细胞系统中(含有RER小泡)加入蛋白水解酶,并不能使新生肽水解。但同时加入去垢剂,则能将蛋白质水解,提示新生肽链是边合成边运输的,因为去垢剂能够破坏内质网的膜,使合成的蛋白质暴露于蛋白水解酶遭到降解。若无去垢剂,多肽在合成的同时就向内质网转运,所以不受蛋白水解酶的影响。
多聚核糖体的离体翻译
从骨髓瘤分离多聚核糖体,用去垢剂处理,使之与内质网膜分离后,继续在无细胞体系(不含RER小泡)中进行翻译,发现:短时间温育,即可得到成熟的分泌蛋白(无信号序列),而长时间的温育,得到的产物N-端有信号序列,这一结果证明了信号序列的功能。
为什么说多聚核糖体是研究内质网帮助蛋白质运输的好材料?
■ 信号序列的一般特征及早期信号假说
● 信号序列的一般特征
G.Blobel、B.Dobberstein、P.Walter和他们的同事在研究中还发现信号序列具有一些共同的特性:长度一般为15~35个氨基酸残基, N-末端含有1个或多个带正电荷的氨基酸,其后是6~12个连续的疏水残基;在蛋白质合成中将核糖体引导到内质网,进入内质网后通常被切除(图9-17)。

图9-17 ER跨膜可切除信号的一般结构
● 早期的信号假说
1975年, G.Blobel和 B.Dobberstein 根据对信号序列的研究成果,正式提出了信号假说(signal hypothesis),要点是:
(1)分泌蛋白的合成始于细胞质中的游离核糖体;
(2)合成的N-端信号序列露出核糖体后,靠自由碰撞与内质网膜接触,然后靠N-端信号序列的疏水性插入内质网的膜;
(3)蛋白质继续合成,并以袢环形式穿过内质网的膜;
(4)如果合成的是分泌的蛋白,除了信号序列被信号肽酶切除外,全部进入内质网的腔,若是膜蛋白,则由一个或多个停止转移信号将蛋白质锚定在内质网膜上。
● 信号假说证明: 基因重组实验
信号假说提出后得到许多实验的支持,其中最有力的一项实验结果是杂合蛋白研究的结果。黑猩猩的α-球蛋白是一种在游离核糖体上合成并存在于胞质溶胶中的可溶性蛋白,科学家在编码该蛋白的基因上接上一段编码E.coli分泌蛋白β-半乳糖透性酶(β-lactamase)的信号序列DNA, 然后将该基因加入到无细胞的转录和翻译体系中,并加入从狗组织中分离的ER膜,研究结果发现,杂合蛋白出现在ER腔中,而且信号序列被切除了。这一研究结果不仅证实了信号假说的正确性,也揭示了信号序列的一个重要特性:信号序列没有特异性,并且原核生物的信号序列在真核生物中也是有效的。
● Blobel 于1972年提出信号序列的建议、1975年正式提出信号假说,揭示了细胞中不同蛋白质在合成后是如何找到自己的工作岗位的秘密,发现了蛋白质与生具来的“地址签”。这一发现开辟了一个全新的医学、细胞生物学和生物技术学的研究领域,基于他的贡献,使他获得了1999年诺贝尔医学奖。
■ 新蛋白复合物的发现与信号假说的补充
● 信号识别颗粒(signal recognition partical, SRP)
1981年,发现了信号识别颗粒(signal recognition partical, SRP),是一种核糖核酸蛋白复合体,沉降系数为11S,含有分子量为72kd、68kDa、54kDa、19kDa、14kDa及9kDa的6条多肽和一个7S(长约300个核苷酸)的scRNA(图9-18), 它的作用是识别信号序列,并将核糖体引导到内质网上。

图9-18 信号识别颗粒(SRP)的组成
● 停靠蛋白 (docking protein, DP)
即SRP在内质网膜上的受体蛋白,它能够与结合有信号序列的SRP牢牢地结合,使正在合成蛋白质的核糖体停靠到内质网上来。
■ 蛋白质共翻译转运的机理:信号假说
● 新信号假说的基本内容
补充修改后的信号假说比早期的信号假说更为合理, 这一假说的核心内容是: 核糖体同内质网的结合受制于mRNA中特定的密码序列(可以翻译成信号肽),具有这种密码序列的新生肽才能连同核糖体一起附着到内质网膜的特定部位。因此,核糖体同内质网的结合是功能性结合,具有功能性和暂时性,并受时间和空间的限制。正是由于这种结合保证了新合成蛋白的矢量释放。信号序列的两个基本作用是:①通过与SRP的识别和结合, 引导核糖体与内质网结合; ②通过信号序列的疏水性,引导新生肽跨膜转运。图9-19是修改后的信号假说的主要内容。

图9-19膜结合核糖体体的蛋白质合成与转运
● SRP、SRP受体功能的离体鉴定
任何假说都要经受得起实验的检验。假说中的SRP、SRP受体的功能都已有体外实验的证明。
请你设计一个离体实验证明SRP和SRP受体的功能。
● 信号肽跨膜的能量来源
研究证明SRP受体和SRP都是G蛋白,它们不仅将合成蛋白质的核糖体引导到内质网, 而且通过GTP-GDP的交换, 将内质网膜中的易位子(translocon)通道打开, 让信号序列与之结合(图9-20)。GTP 水解作为信号序列转运的能量来源。

■ 膜蛋白的共翻译转运机理
在粗面内质网上合成的蛋白质有两类:分泌蛋白和膜蛋白,膜蛋白的共翻译转运较为复杂,首先它要靠疏水区滞留在内质网上,另外膜蛋白分单次跨膜和多次跨膜;还有膜蛋白在膜上的定向问题,即羧基端和氨基端位于内质网膜的内侧(内质网腔面)还是外侧(胞质溶胶一侧),还是位于同一侧。
● 起始转移信号(start-transfer signal)
蛋白质氨基末端的信号序列除了作为信号被SRP识别外, 还具有起始穿膜转移的作用。在蛋白质共翻译转运过程中,信号序列的N-端始终朝向内质网的外侧,插入蛋白质转运通道后与通道内的信号序列结合位点(受体)结合,其后的肽序列是以袢环的形式通过运输通道。[]
● 内含信号序列(internal signal sequence) 与单次跨膜蛋白
内含信号序列又称内含信号肽(internal signal peptides),它不位于N-末端,但具信号序列的作用,故称为内含信号序列。它可作为蛋白质共翻译转移的信号被SRP识别,同时它也是起始转移信号。由于内含信号序列是不可切除的,又是疏水性,所以它是膜蛋白的一部分,如果共翻译转运蛋白质中只有一个内含信号序列,那么合成的蛋白就是单次跨膜蛋白(图9-21)。

图9-21 内含信号序列与单次跨膜蛋白的整合
内含信号序列首先作为信号序列与SRP一起将核糖体附着到内质网,然后作为起始转移信号与蛋白质转运通道结合引导新生肽的转移。在与转运通道结合过程中,始终保持具有较多正电荷氨基酸的一端朝向胞质溶胶一侧,由于它不能被切除,所以合成的是膜蛋白。(a) 内含信号序列作为起始转移信号,在保持信号序列中具有较多正电荷氨基酸一端朝向胞质溶胶面的情况下与羧基端的臂形成环,插入到转运通道中。(b)作用方式与(a)相同,只是内含信号序列中含较多正电荷一端与氨基端相反,所以要进行调整,在跨膜时保持正电荷一端朝向胞质溶胶面。
● 停止转移肽(stop-transfer peptide)与单次跨膜蛋白
单次跨膜蛋白的形成除了与含有内含信号序列有关外,终止转移肽也与单次跨膜蛋白的形成相关。
因停止转移信号的作用而形成单次跨膜的蛋白,那么该蛋白在结构上只有一个停止转移信号序列,没有内含转移信号,但在N-端有一个信号序列作为转移起始信号(图9-22)。

图9-22 终止转移信号与单次跨膜蛋白的形成
该蛋白在N-末端信号序列的作用下进行共翻译转运,当停止转移信号进入通道后,与通道内的结合位点相互作用,使通道转运蛋白失活,从而停止蛋白质的转运。由于N-末端的信号序列是可切除的,信号序列被切除后形成单次跨膜蛋白。
二次跨膜蛋白与多次跨膜蛋白
所谓二次跨膜就是在蛋白质中有两个跨膜的疏水区,多次跨膜则有多个起始跨膜信号与多个停止转移信号,它们的形成与内含信号序列和终止转移信号相关。
如果是二次跨膜,则含有一个内含信号序列和一个停止转移信号(图9-23)。

图9-23 二次跨膜蛋白的形成
内含信号序列形成一个跨膜区,停止转移序列形成一个跨膜区,二者相加就成为二次跨膜蛋白。
在了解了二次跨膜形成的方式之后,不难推测多次跨膜蛋白的形成一定含有多个内含信号序列和多个停止转移信号。
根据信号假说, 膜蛋白(单次和多次跨膜)是怎样形成的?
■ Bip在ER蛋白的转移和装配中的作用
研究发现进入内质网腔中的蛋白质片段很快被一些称为Bip的蛋白结合。
Bip蛋白是重链结合蛋白 (heavy-chain binding protein) 的简称,因为它能够同IgG抗体的重链结合。Bip是一类分子伴侣,属于Hsp70家族,在内质网中有两个作用。
●Bip同进入内质网的未折叠蛋白质的疏水氨基酸结合,防止多肽链不正确地折叠和聚合(图9-24)。
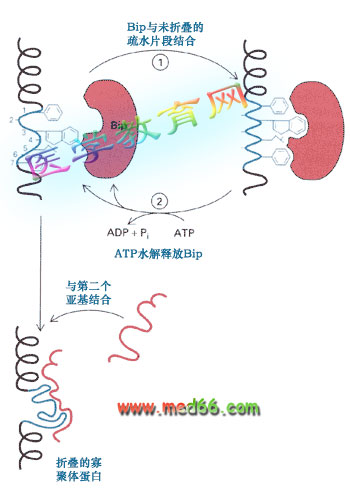
图9-24 Bip在ER腔中的作用
Bip与转运到ER中蛋白的疏水部分结合,防止蛋白质的变性或降解,使其正确地折叠。结合有蛋白质的Bip在ATP水解后释放被结合的蛋白,如果释放的蛋白仍然是未折叠的,Bip将重新与这种蛋白结合。Bip还可帮助两种不同的蛋白共同装配。
● Bip的第二个作用是防止新合成的蛋白质在转运过程中变性或断裂。通过重组DNA技术,将酵母中编码Bip蛋白的基因突变成温度敏感型后,当提高细胞培养温度时,Bip的功能就会丧失,蛋白质向ER的转移也会停止,推测由于Bip功能的丧失,导致蛋白质在ER中的聚集,抑制了新生肽向ER的转移。
■ 蛋白质在内质网中的修饰
新生肽进入ER腔之后除了要进行正确的折叠之外,还要经过各种不同的修饰之后才能运送到其它的部位。
● N-连接糖基化(N-linked glycosylation)
糖基化的第一步是将一个14糖的核心寡聚糖添加到新形成多肽链的天冬氨酸上,其氨基酸的特征序列是Asn-X-Ser/Thr(X代表任何一种氨基酸), 由于糖是同天冬酰胺的自由NH2连接,所以将这种糖基化称为N-连接的糖基化(图9-25)。
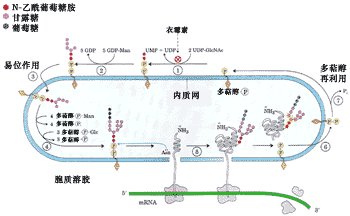
图9-25 正在ER中合成蛋白质的N-连接糖基化
● 羟基化(hydroxylation)
除了N-连接糖基化以外,新生肽的脯氨酸和赖氨酸要进行羟基化,形成羟脯氨酸和羟赖氨酸,不过这种反应只是在少数蛋白上发生。在合成胶原的细胞中,脯氨酸和赖氨酸羟基化则是一个主要的反应。
● 形成脂锚定蛋白[]
新合成的蛋白质除了成为跨膜蛋白或ER腔中的游离蛋白外,还会通过酰基化同ER膜上的糖脂结合,将自己锚定在ER膜上。图9-26是新合成的ER蛋白被信号肽酶从ER上切割之后,立即通过羧基端与已存在于ER膜上的糖基磷脂酰肌醇共价结合,形成脂锚定蛋白的简化过程。形成的脂锚定糖蛋白通过进一步的运输成为质膜外侧的膜蛋白。

图9-26 蛋白质附着到糖基磷脂酰肌醇成为脂锚定蛋白
● 翻译后跨ER膜运输
某些蛋白质也可通过翻译后跨ER膜运输,由于这些蛋白的信号序列太短而无法与SRP相互作用, 它们主要是靠分子伴侣维持非折叠状态进行跨膜转运。关于翻译后跨ER膜运输的详细机理还不太清楚。

